药物重定位,即“老药新用”,是发现已上市的药物新适应症的应用策略。该策略是解决药物研发高投入低成功率困境的有效方法之一。随着生物信息学的发展以及各种药物信息学数据库的大量产出,药物重定位策略已从依赖临床观察的经验性研究向基于大规模组学和医药大数据分析的理性预测和实验筛选验证相结合的模式转变。美国国立卫生研究院于2011年启动了细胞反应印记整合图书馆(LINCS)项目,该项目中收集了丰富的小分子化合物对多种类细胞不同条件刺激下的表达谱数据信息。通过整合疾病状态和药物刺激状态下的表达谱数据可以用于进行药物重定位的研究。
近日,Antiviral Research杂志发表了我校实验中心王晓龙博士为第一作者,王振国教授、王升启教授为共同通讯作者的文章“LINCS Dataset-Based Repositioning of Rosiglitazone as a Potential Anti-human Adenovirus Drug”。该研究基于表达谱印记方法发现抗人腺病毒(HAdV)药物。


图1 论文研究思路与成果概要
研究整体思路是利用实验测得的人腺病毒感染宿主细胞的动态转录组表达谱RNAseq数据,通过与LINCS数据库中药物扰动表达谱进行比对,首先预测出若干种可能具有抗人腺病毒活性的已上市药物;其次,对预测排名较高的十种药物进行活性初筛;最后,对目标药物罗格列酮(FDA批准用于治疗II型糖尿病)进行系统的体外、体内抗人腺病毒活性评价并探讨其抑制病毒复制的潜在机制。
在体外实验中,通过三种检测方法(CPE抑制实验、空斑法、q-PCR法),针对三种不同血清型人腺病毒(5型、7型、55型),在不同细胞系(A549细胞、Hep-2细胞、Vero细胞)感染模型下对罗格列酮进行了系统的活性评价,均做出了有效性验证,体现出罗格列酮良好的抑制人腺病毒复制的作用。进一步研究表明,罗格利酮可能部分通过直接激活PPARγ受体,并且在PGC1α辅助因子的协同作用下促进STAT1蛋白的磷酸化,与IRF9结合后诱导激活I型干扰素信号通路发挥抑制人腺病毒复制的作用。
由于人腺病毒具有一定的宿主种属特异性,缺乏良好的支持该病毒感染的动物模型使得抗腺病毒药物研究进展比较缓慢。本研究中首次利用C.B 17 SCID小鼠(严重的联合免疫缺陷的品系小鼠),采用滴鼻造模方法,成功建立了人腺病毒感染动物模型。该模型小鼠肺组织发生明显病理改变,形成实质性肺炎;血清和肺组织中一系列趋化因子及单细胞、巨噬细胞刺激因子的含量水平显著升高;感染8天后小鼠肺组织中仍持续了较高滴度的感染性病毒。应用该模型,以西多福韦作为阳性对照药,在感染后的第3天和第5天,与模型组相比,罗格列酮均能够减轻病理变化,显著降低肺组织中感染性病毒载量。
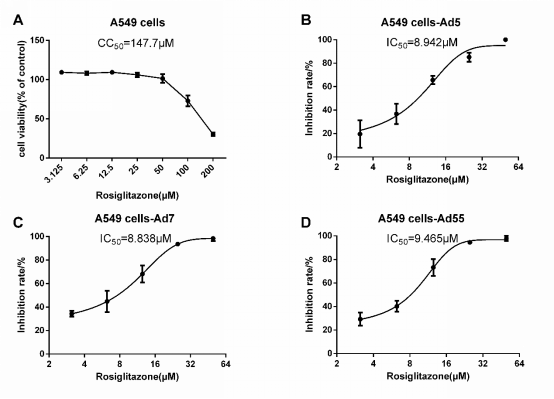
图2 罗格列酮体外剂量依赖性抑制HAdV感染性病毒滴度
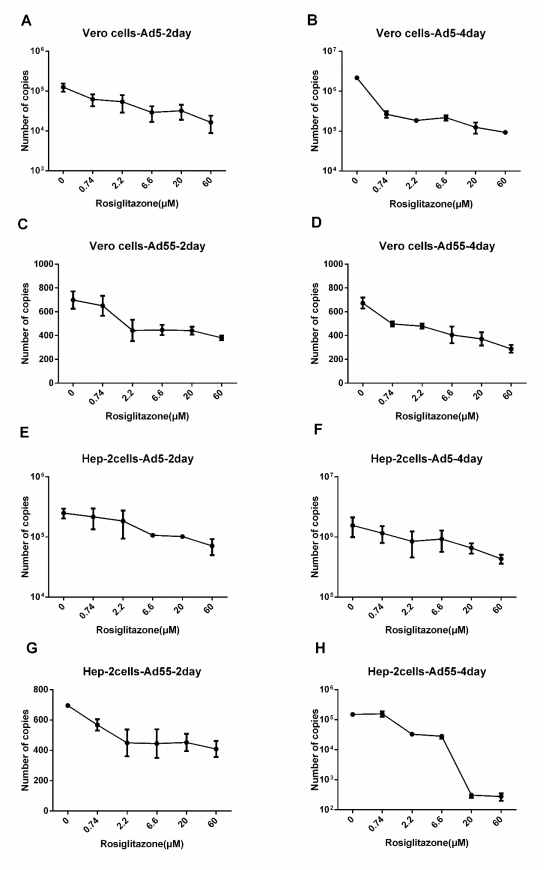
图3 罗格列酮体外剂量依赖性抑制HAdV病毒DNA拷贝
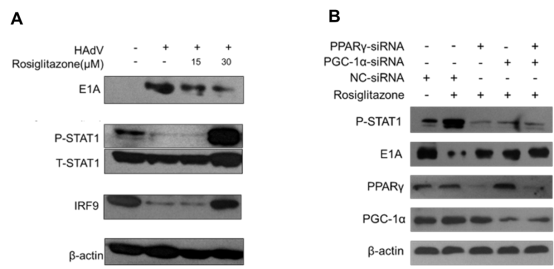
图4 PPARγ及PGC-1α沉默对罗格列酮发挥作用的影响

图5 罗格列酮诱导抗病毒IFN应答基因的表达
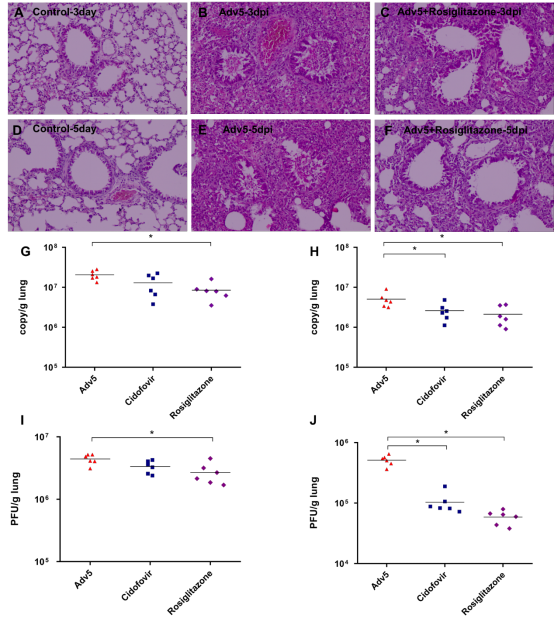
图6 罗格列酮减轻HAdV感染SCID小鼠的肺组织病理症状和感染性病毒载量
该研究展示了结合自测时间进程转录组数据,在公共基因表达数据库中发现药物的计算分析模式,表明这是一种潜在有用的药物发现方法。尽管对罗格列酮的研究结果还需要在更大的随机前瞻性临床试验中开展进一步的临床前试验,但仍然为促进这一老药新用的转化奠定了基础。
文章链接:https://doi.org/10.1016/j.antiviral.2020.104789